مروری بر پاتوفیزیولوژی ودرمان آلزایمر
بیماری آلزایمر، شایع ترین علت دمانس بوده و در سالمندان با مرگ و میر بالایی در ارتباط می باشد. امروزه در سراسر جهان 47 میلیون نفر به این بیماری مبتلا هستند که 13% از افراد بالای 65 سال و 45 % از افراد بالای 85 سال در این گروه جای میگیرند.

مقدمه
بیماری آلزایمر، شایع ترین علت دمانس بوده و در سالمندان با مرگ و میر بالایی در ارتباط می باشد. امروزه در سراسر جهان 47 میلیون نفر به این بیماری مبتلا هستند که 13% از افراد بالای 65 سال و 45 % از افراد بالای 85 سال در این گروه جای میگیرند. پیشبینی میشود تا سال 2050، در هر 33 ثانیه یک نفر به این بیماری مبتلا شده و در مجموع تعداد موارد جدید در هر سال به یک میلیون نفر برسد.
ویژگیهای آسیبشناسی بیماری آلزایمر
اگرچه علت بیماری آلزایمر هنوز بهطور کامل شناسایی نشده است، به نظر میرسد فرضیه آبشار آمیلوئیدی اصلی ترین علت وقوع این بیماری باشد. تصور بر این است که عدم تعادل بین تولید و پاکسازی پروتئین های آمیلوئید بتا در مغز و متعاقب آن اختلال در عملکرد سیناپسی و تحلیل رفتن نورونها عامل اصلی اختلال پیشرونده و برگشتناپذیر حافظه بوده و قدرت تکلم، شخصیت و شناخت را تحت تاثیر قرار میدهد. این فرضیه در شکل 1 به صورت اجمالی نشان داده شده است.
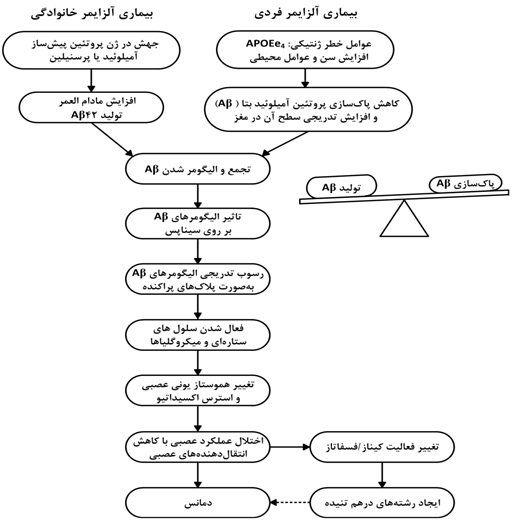
شکل 1- فرضیهی آبشار آمیلوئیدی
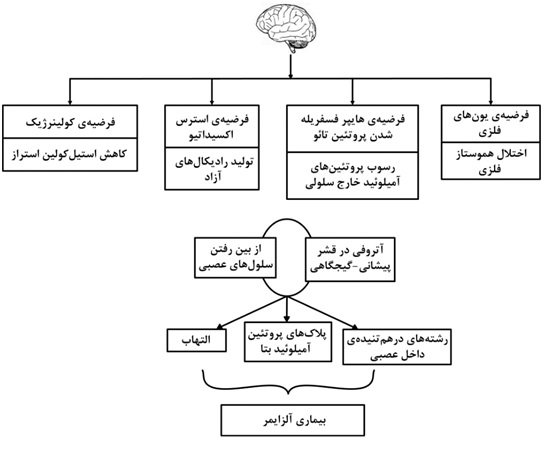
پلاکهای آمیلوئیدی از تجمع پروتئینهای آمیلوئید بتا تشکیل شدهاند که خود از یک پروتئین مادر به نام پروتئین پیش ساز آمیلوئید[1]مشتق میگردند. سه نوع آنزیم سکرتاز (آلفا، بتا و گاما) پروتئین پیشساز آمیلوئید را به اجزای محلول تجزیه می نمایند. در صورت شکست نامناسب این پروتئین توسط آنزیم های سکرتاز بتا و گاما، پروتئینهای آمیلوئید بتای نامحلول تشکیل میشوند که در مغز تجمع یافته و منجر به تشکیل پلاکهای آمیلوئیدی، سمیت مغزی و مرگ سلولی میگردند. رشتههای در هم تنیده داخل نورونی، متشکل از رشتههای حاوی فرم فسفریلهی پروتئینهای تائو[2] هستند. پروتئینهای تائو بهطور طبیعی حاوی مولکولهای فسفات هستند. در بیماری آلزایمر، این پروتئینها بیش از اندازه فسفریله می شوند و این امر منجر به پیچ خوردن آنها اطراف یکدیگر و تشکیل کلافههای نامحلول می گردد و در نتیجه این اتفاق، حضور ماکروفاژها و سلولهای تک هستهای در قشر مغز و فعال شدن میکروگلیاها در پارانشیم، زوال عقل و آتروفی قشر پیشانی– گیجگاهی[3] به دنبال می آید. در شکل 2 این روند پاتولوژیک به صورت کلی نشان داده شده است.
شکل 2- پاتوفیزیولوژی بیماری آلزایمر
اگرچه متخصصین علم نوروپاتولوژی بر این باور هستند که پلاکهای آمیلوئیدی و رشتههای در هم تنیدهی داخل نورونی مهمترین عامل ایجاد بیماری آلزایمر هستند، فاکتورهای مستعدکنندهی دیگری نیز وجود دارند که در ادامه به آنها به صورت کلی پرداخته می شود؛
- در بعضی از خانوادهها، مکانیسمهای ژنتیکی برای بروز این بیماری تشخیص داده شده است که از این میان میتوان به الل e-4 آپولیپوپروتئین E[4] اشاره نمود. آپولیپوپروتئین E نقش مهمی در تجزیه و پاکسازی پروتئین پیشساز آمیلوئید داشته و به نظر میرسد ناقلین الل e-4 توانایی لازم برای پاکسازی فرآوردههای حاصل از تجزیه این پروتئین اصلی را نداشته و در نتیجهی این امر، تولید و تجمع پروتئینهای بتا در بدن فرد افزایش مییابد.
- التهاب عصب یک فاکتور مهم به عنوان عامل ایجادکنندهی بیماری و همچنین حاصل از ایجاد بیماری می باشد. احتمالا تولید پلاکها و رشتههای در هم تنیده تا حدودی در ارتباط با فرآیند التهاب ناشی از افزایش سن رخ می دهد. تولید پلاکها و رشتههای در هم تنیده خود موجب بروز التهاب شده و منجر به تسریع تشکیل پلاکهای بعدی و زوال شناخت میگردند.
عوامل خطر اکتسابی
در یک سوم از موارد شناخته شدهی بیماری در یک آنالیز آماری، عواملی همچون بیماری دیابت، فشار خون بالا، چاقی، عدم فعالیت فیزیکی، افسردگی، کشیدن سیگار و سطح تحصیلات پایین به عنوان ریسک فاکتورهای قابل تغییر مستعدکنندهی فرد برای ابتلا به بیماری آلزایمر گزارش شده اند. عوامل متفاوت چندژنی و اکتسابی میتوانند خطر بروز بیماری آلزایمر را افزایش دهند که از جملهی آنها میتوان به اختلالات چربی، بیماری مغزی-عروقی، تغییر متابولیسم قند و ضربه مغزی اشاره نمود. بسیاری از این عوامل خطر در صورت بروز در میانسالی ارتباط بیشتری با بروز آلزایمر دارند. مدیریت سختگیرانهی عوامل عروقی در میانسالی، راهکار کلیدی برای کاهش خطر، پیشرفت و شدت بیماری آلزایمر و سایر فرمهای دمانس است.
1. فشار خون بالا
در مطالعات مقطعی[5] و مطالعات مورد هم گروهی طولانی مدت[6]،فشار خون بالای دوره میانسالی همواره با خطر بروز بیماری آلزایمر و دمانس در ارتباط است. این خطر به واسطهی بیماریهای مغزی-عروقی و اثر طولانی مدت فشار خون بالا ایجاد میشود و در صورت وجود دیابت و مصرف سیگار این خطر افزایش می یابد. این ارتباط در خانمها نسبت به آقایان قویتر است هرچند که این امر در تمامی موارد صادق نمی باشد. سفتی شریانها و نوسانات فشار خون نقش مهمی در رابطهی بین فشار خون و ریسک بروز بیماری آلزایمر ایفا مینماید. سفتی شریانها با افزایش سن و سطح فشار خون، دیابت و استعمال سیگار افزایش مییابد. در یک مطالعه مورد همگروهی، سفتی شریانها (مستقل از سطح فشار خون و ژنوتیپ آپولیپوپروتئین E) بهطور مستقیم با رسوب پلاکهای آمیلوئید بتا در ارتباط بود. درحالیکه مطالعات مشاهداتی[7] نشان میدهد که درمان فشار خون بالا خطر بروز دمانس را کاهش می دهد، کارآزماییهای بالینی درمان فشار خون بالا، همواره کاهش این خطر را گزارش نمینمایند اما این نکته قابل توجه می باشد که اکثر این کارآزماییها پیامد کوتاه مدت را بررسی نمودهاند و ممکن است درمان فشار خون بالا به صورت طولانی مدت (به ویژه در دورهی میانسالی) بتواند خطر بروز بیماری آلزایمر را در سالهای آتی زندگی فرد تغییر دهد.
2. اختلالات چربی
با وجود اینکه برخی از مطالعات اپیدمیولوژیک، ارتباطی بین سطح کلسترول تام و کلسترول لیپوپروتئین با چگالی پایین[8] با خطر بروز بیماری آلزایمر مطرح نمودهاند، تفسیر این مطالعات دشوار است. کلسترول لیپوپروتئین با چگالی پایین خون محیطی توانایی عبور از سد خونی- مغزی را ندارد مگر اینکه این سد با عواملی مانند بیماریهای عروقی آسیب دیده باشد. بیشتر کلسترول موجود در مغز، توسط سلولهای ستاره ای[9]و نورونها ساخته شده و توسط لیپوپروتئین با چگالی بالا[10] در اختیار سلولهای مغزی قرار میگیرد و کلسترول لیپوپروتئین با چگالی پایین در مغز یا بسیار ناچیز است و یا اصلا وجود ندارد. با این وجود، دادههای مشاهداتی از ارتباط بین سطح کلسترول تام و کلسترول لیپوپروتئین با چگالی پایین و خطر بروز بیماری آلزایمر حمایت میکنند.
در یک مطالعهی مورد هم گروهی طولانی مدت، افزایش احتمال سه برابری ابتلا به بیماری آلزایمر در بیماران با سطح تام کلسترول بالا در دوره میانسالی با میانگین سن تقریبی 50 سال به صورت مستقل از ژنوتیپ آپولیپوپروتئین E، سطح تحصیلات، استعمال سیگار و مصرف الکل، گزارش شده است. در مورد ارتباط سطح کلسترول تام خون در دورهی کهنسالی و احتمال بروز بیماری آلزایمر، دادههای متناقضی در دسترس می باشند و در برخی از مطالعات ارتباط مستقیم ، در برخی از مطالعات ارتباط معکوس میان این دو متغیر و در برخی مطالعات عدم وجود ارتباط مشخص گزارش شده است. همچنین، در بیماران مبتلا به آلزایمر، افزایش سطح کلسترول تام و کلسترول لیپوپروتئین با چگالی پایین با اختلالات شناختی بیشتر همراه بوده است. تصور می شود که کلسترول موجود در مغز به واسطهی افزایش تشکیل و یا رسوب پروتئینهای آمیلوئید بتا و یا با اثر بر روی سایر عوامل غیر آمیلوئیدی همچون مشکلات مغزی- عروقی، التهاب موضعی و متابولیسم پروتئینهای تائو خطر بروز بیماری آلزایمر را افزایش میدهد. بر اساس این دادهها، تحقیقات به سمت مصرف داروهای کاهندهی کلسترول خون برای پیشگیری از بیماری آلزایمر سوق پیدا کرده است. کارآزماییهای تصادفی[11] در اثبات اثرات محافظتی داروهای استاتین بر روی شناخت در بیماران قلبی- عروقی و یا در افراد با ریسک بالای بیماری قلبی- عروقی موفق عمل نکردهاند. داروهای استاتین خوراکی در کاهش سرعت زوال شناخت در بیماران دچار بیماری آلزایمر با شدت خفیف- متوسط اثر مثبتی نداشته اند.
3. بیماریهای عروق مغزی
این دسته بیماریها با بیماری آلزایمر همراهی داشته و به وجودهمزمان بیماری آلزایمر با مشکلات عروقی، اصطلاح mixed dementiaاطلاق میگردد. بیماریهای عروق کوچک مغزی در سنین بالا شایعتر بوده و با عواملی همچون فشار خون بالا، دیابت، استعمال سیگار، چاقی، فعالیت فیزیکی پایین و اختلال چربی در ارتباط می باشد. کاهش جریان خون قبل از رسوب پروتئین آمیلوئید بتا در مدل های موشی آلزایمری نشان داده شده است و مطالعات انسانی، مؤید تجمع پروتئینهای آمیلوئیدی در نتیجه اختلال کلیرانس آنها می باشد.
در یک مطالعه مورد هم گروهی نشان داده شد که جریان خون مغزی[12] کاهش یافته و اختلالات مادهی سفید، با افزایش خطر ابتلا به بیماری آلزایمر همراهی داشته اند. در کالبدشکافیهای انجام شده بر روی بیماران دچار بیماری آلزایمر، آسیبشناسی عروقی در35 تا50 درصد بیماران مبتلا به آلزایمر یافت میشود. از سوی دیگر، یک سوم بیماران با تشخیص قطعی دمانس عروقی [13] در کالبدشکافی، اختلالات مربوط به بیماری آلزایمر را نشان می دهند. در صورتیکه یافتههای آسیب شناسی تاییدکنندهی بیماری آلزایمر نباشند، همراهی سکته های وسیع و lacunas با احتمال بالاتر، میتواند تاییدکنندهی تشخیص باشد.
ژنوتیپe - 4 آپولیپوپروتئین E، با افزایش خطر ابتلا به بیماری آلزایمر و مشکلات قلبی- عروقی همراه می باشد. در یک مطالعه، در ناقلین اللe - 4 آپولیپوپروتئین E شدت بیماریهای عروق کرونر به طور واضحی باافزایش تراکم یافته های آسیب شناختی- عصبی[14]بیماری آلزایمر در ارتباط بود. در یک مطالعهی دیگر، ارتباط الل e - 4 آپولیپوپروتئین E با تغییرات مویرگی در ناحیه زیرقشری در بیماران مبتلا به آلزایمر به اثبات رسید اما این تغییرات به نفع آسیب مغزی- عروقی وسیع نبودند. بیماری عروق مغزی با عملکرد شناختی بدتر در بیماران دچار بیماری آلزایمر همراه است و مطالعات بالینی- آسیب شناختی [15] نشان میدهند که این دسته از بیماریها آستانهی بروز دمانس را در بیماران با تشخیص بیماری آلزایمر کاهش میدهند.
4. داروها
بسیاری از مطالعات وجود ارتباط میان مصرف دسته های دارویی متفاوت مانند داروهای بنزودیازپین، داروهای واجد اثر یا عوارض آنتی کولینرژیک، داروهای آنتی هیستامین و داروهای اپیوئید و بروزاختلالات شناختی را در سالمندان تایید نموده اند اما در غالب موارد ذکر شده است که این اثرات گذرا و برگشت پذیربوده اند. مواجههی طولانی مدت با این داروها در بسیاری از مطالعات با افزایش خطر بروز بیماری آلزایمر و انواع دیگر دمانس در ارتباط بوده است. این مطالعات همچنین بیان میکنند که ممکن است اثرات شناختی ناشی از داروها در برخی از بیماران برگشتپذیر نباشد و یا این مواجههی طولانی مدت موجب پیشرفت بیماری آلزایمر از مرحله بدون علامت یا ابتدایی علامت [16] به مرحله واجد علامت گردد. در ادامه به برخی از این نوع داروها اشاره می گردد.
• داروهای بنزودیازپین
دادههای متناقضی در رابطه با ارتباط میان مصرف این دسته دارویی و خطر بروز دمانس در دسترس می باشند. در یک مطالعه مورد- شاهدی [17] شامل 2000 فرد سالمند، پس از تعدیل متغیرهای مداخله گر[18] متعدد مانند اضطراب ، افسردگی و بی خوابی، دریافت داروهای بنزودیازپین برای بیش از 180 روز با افزایش خطر بروز بیماری آلزایمر به میزان 1.5 برابر همراه بود، از طرفی رابطه دوز – پاسخ، افزایش میزان عارضه با افزایش طول مدت دریافت دارو و افزایش میزان بروز عارضه با افزایش نیمه عمر دارو نیز گزارش گردید. این احتمال وجود دارد که داروهای بنزودیازپین برای درمان علائم اولیه بیماری آلزایمر مورد استفاده قرار گرفته باشند، از همین رو محققان شرط ورود به مطالعه را افرادی قرار دادند که تجویز این دسته دارویی حداقل 5 سال قبل از تشخیص بیماری آلزایمر آنها انجام شده باشد. مطالعات بزرگ دیگر موفق به نشان دادن ارتباط میان مصرف طولانی مدت داروهای بنزودیازپین و رخداد دمانس نشدند.
• داروهای واجد اثرات یا عوارض آنتی کولینرژیک
در یک مطالعه آینده نگر، شامل بررسی هفت ساله ی بیش از 3400 نفر بیمار سالمند که در ابتدای ورود به مطالعه به دمانس مبتلا نبودند،دوزهای تجمعی بالا از داروهای آنتی کولینرژیک موجب افزایش خطر ابتلا به دمانس گردید. شایع ترین داروهای آنتی کولینرژیک که توسط بیماران مورد استفاده قرار گرفته بودند شامل داروهای ضد افسردگی سه حلقهای، آنتی هیستامین نسل اول، و آنتی موسکارینهای موثر در مثانه بودند.
• مهارکنندههای پمپ پروتون [19]
همانند داروهای بنزودیازپین، دادههای متناقضی در رابطه با ارتباط میان مصرف این دسته دارویی و خطر بروز دمانس وجود دارد. حداقل دو مطالعه ارتباط واضحی میان مصرف این دسته دارویی و پیشامد دمانس گزارش نموده اند. در یک مطالعه مورد هم گروهیِ آیندهنگر شامل 73000 بیمار با سن 75 و یا بالاتر، که در ابتدا به دمانس مبتلا نبودند، مصرف منظم مهارکنندههای پمپ هیدروژنی منجر به افزایش خطر بروز دمانس شد که این ارتباط بعد از تعدیل متغیرهای مخدوشگر شامل سن، جنس، افسردگی، سکته، بیماریهای قلبی و مصرف هم زمان چند دارو، معنادار گزارش شد. در مقابل، دو مطالعهی مشاهده ای دیگر، شامل یک مطالعه مورد- شاهدی گسترده با بیش از 70000 مورد بیماری آلزایمر که از لحاظ سن، جنس و منطقه واجد نمونهی شاهد بودند، هیچ نوع ارتباط میان مصرف این دسته دارویی و افزایش خطر بروز بیماری آلزایمر و یا مدرکی مبنی بر ارتباط دوز- پاسخ گزارش نکردند. دادههای محدود پیش از کارآزمایی، نشاندهندهی برهمکنش بین این ترکیبات و پروتئینهای بتا و تائو است. سوء جذب ویتامین ب 12 و سایر ترکیبات مغذی، در اثر مصرف طولانی مدت مهارکنندههای پمپ پروتون ممکن است نقش مهمی در این رابطه ایفا نماید.
عوامل خطر محیطی
از آنجا که مطالعات گستردهی ژنتیکی اللهای محدودی را به عنوان عوامل مستعدکنندهی فرد برای ابتلا به بیماری آلزایمر مطرح نموده اند، نظر محققان به سمت عوامل محیطی و سمی به عنوان عامل خطر بروز بیماری جلب گردید که از این میان میتوان به موارد زیر اشاره نمود.
1. دود غیرمستقیم سیگار: در یک مطالعهی مقطعی در چین بر روی افراد با سن 60 سال و بالاتر که تا به حال سیگار مصرف ننموده بودند، مواجهه با دود غیر مستقیم سیگار با افزایش خطر ابتلا به بیماری آلزایمر در ارتباط بود و این ریسک برای مواجهه در خانه بیشتر از مواجهه در محل کار گزارش شد.
2. آلودگی هوا: مطالعات حیوانی و مطالعات انسانی محدود از آلودگی هوا به عنوان یک عامل مهم مستعدکنندهی فرد برای ابتلا به بیماری آلزایمر حمایت مینمایند. افزایش انتشار پلاکهای آمیلوئیدی و التهاب در پیاز بویایی، هیپوکمپ و لوبهای پیشانی در نمونههای کالبدشکافی دریافت شده از بالغین ساکن مکزیکوسیتی و مونتری، که به عنوان دو ناحیهی آلوده، شناخته شده اند، در مقایسه با افرادی که درشهرهای کوچکتر و با آلودگی محیطی پایین تر ساکن بودند، مشاهده شد. در بررسی های انجام شده بر روی نمونه های حاصل از کودکان و افراد جوان ، یافته های مشابهی گزارش گردید.
3. موادآفت کش: مطالعات بسیاری مواجهه شغلی و محیطی با مواد آفت کش را از عوامل خطر ابتلا به بیماری آلزایمر ذکر کرده اند. به عنوان مثال، در یک مطالعهی مورد- شاهدی غلظت سرمی ترکیب دی کلرو دی فنیل دی کلرو اتیلن [20] در 86 بیمار مبتلا به آلزایمر که از طریق یافته های آسیب شناختی تایید گردیده بود، و 79 شاهد اندازهگیری شد. در این مطالعه غلظت این ترکیب در افراد مبتلا به آلزایمر 3.8 برابر افراد شاهد بود.
درمانهای دارویی مطرح در حال حاضر
در حال حاضر چهار درمان دارویی برای بیماری آلزایمر وجود دارد که همگی بیش از یک دههی گذشته تاییدیهی سازمان غذا و داروی آمریکا را دریافت نموده اند. از بین این چهار دارو خط اول درمان، داروهای مهارکنندهی آنزیم استیل کولین استراز، شامل داروهای دونپزیل، ریواستیگمینو گالانتامین، هستند. این داروها با مهار این آنزیم، غلظت استیل کولین، که انتقالدهندهی عصبی[21]مسئول عملکرد شناختی و حافظه می باشد، را در مغز افزایش می دهند. از آنجا که این دستهی دارویی سرعت پیشرفت اختلال شناختی را کاهش می دهد، برای درمان دمانس در بیماران مبتلا به آلزایمر تاییدیه گرفتهاند. اثربخشی این سه دارو در بیماری آلزایمر با شدت های متفاوت مورد مطالعه قرار گرفته است. شدت بیماری با توجه به امتیاز به دست آمده از تستهای مختلف در Error! Reference source not found. قابل طبقه بندی می باشد.
|
نام تست شدت بیماری |
Montreal Cognitive assessment (MoCA) |
Mini-Mental State Examination (MMSE) |
Clinical Dementia Rating (CDR) |
|
خفیف |
16-12 |
26-19 |
1 |
|
متوسط |
11-4 |
18-10 |
2 |
|
شدید |
4 |
10 |
3 |
جدول 1- شدت بیماری آلزایمر بر اساس تستهای مختلف
دمانس خفیف تا متوسط: اگرچه نتیجهی اثربخشی داروهای مهار کننده استیل کولین استراز در این بیماران طبق مطالعات مختلف، از عدم اثربخشی قابل ملاحظه در 30-50 % از بیماران تا اثربخشی بالاتر از حد متوسط در 20% از بیماران، متفاوت بوده است، در یک نگاه کلی سودمندی آنها در حد بهبود جزئی در شناخت، اختلالات عصبی-روانی و فعالیتهای روزمره ارزیابی می گردد.
دمانس شدید: اثرات نسبی داروهای مهار کننده استیل کولین استراز در بیمارانی که در هنگام تشخیص علائم شدید را داشته باشند، مشابه بیماران گروه قبل گزارش شده است. بایستی توجه داشت که مطالعات محدودتری، نسبت به بیماران با علائم خفیف تا متوسط در این گروه انجام شده است. در مراحل اولیهی دمانس متوسط تا شدید، در بیماران خانهدار که قبلا درمان دریافت ننموده باشند و بیمارانی که تحت نظر پرستار در منزل نگهداری میشوند، دو داروی دونپزیل و گالانتامین به صورت جزئی برای بهبود برخی از علایم شناختی و عملکردی بیماران سودمند واقع شده اند. هیچ تفاوت معناداری از نظر اثر بخشی بین داروهای این دسته وجود ندارد. اغلب داروی دونپزیل به علت تحمل بهتر در بیماران تجویز میگردد اما هر کدام از داروهای این دسته ممکن است برای شروع درمان مورد استفاده قرار گیرند. تمام بیماران باید از نظر اختلالات شناختی، کاهش وزن و مشکلات گوارشی مورد ارزیابی قرار گیرند. انجمن سالمندان آمریکا در سال 2015 در مورد مصرف این دستهی دارویی به علت ایجاد عارضهی کاهش ضربان قلب و افت فشار خون وضعیتی در بیماران با سابقه سنکوپ هشدار داده است.
داروی چهارم، ممانتین[22] بوده که این دارو نیز برای درمان دمانس در بیمار مبتلا به بیماری آلزایمر از سازمان غذا و داروی آمریکا تاییدیه دریافت نموده است. ممانتین، مهارکنندهی گیرندهی ان- متیل دی- آسپارتات[23] بوده و از اتصال گلوتامات، انتقالدهندهی عصبی تحریکی در سیستم عصبی مرکزی، به گیرندهی مربوطه ممانعت مینماید. این واقعه از مرگ سلول عصبی در اثر تحریک بیش از اندازهی گلوتامات جلوگیری کرده و متعاقب این عمل مانع پیشرفت بیماری آلزایمر میگردد. در مراحل پیشرفتهی بیماری آلزایمر، داروی ممانتین به صورت ترکیبی در کنار یک دارو از دستهی مهارکنندهی آنزیم استیل کولین استراز تجویز میگردد. امروزه، فرآوردهی تجاری ترکیبی ممانتین و دونپزیل در بازارهای دنیا موجود است. نکات مربوط به چهار داروی مورد استفاده در بیماری آلزایمر در جدول های زیر آورده شده اند.
تمام داروهای مورد استفاده در بیماری آلزایمر، سرعت پیشرفت بیماری را کاهش داده و زمان گسترش علائم را به تاخیر می اندازند اما هیچ کدام به طور قابل توجهی عملکرد شناختی را بهبود نبخشیده و بیماری را درمان نمیکنند. تصور بر این است که این داروها به مقدار کم اثربخش بوده و اهمیت بالینی اثربخشی آنها زیر سوال است. این نکته از دو جهت حائز اهمیت است:
- بیمار و اعضای خانواده وی بایستی آگاهی کامل داشته باشند تا از داشتن انتظارات غیر واقعبینانه نسبت به دارودرمانی پرهیز نمایند.
- در صورت عدم پاسخدهی مناسب بیمار به دارودرمانی و یا بروز عوارض دارویی نیازی به ادامه مادامالعمر دارو نبوده و تجویز آن باید متوقف گردد.
|
دارو |
دونپزیل |
گالانتامین |
ریواستیگمین |
|
عارضهیجانبی |
تهوع-استفراغ- اسهال-سرگیجه–سردرد-کاهشوزن |
||
|
دوز |
قرص سریع رهش: ابتدا، 5 میلی گرم روزانه و سپس افزایش دوز تا 10 میلی گرم روزانه بعد از 4-6 هفته
قرص 23 میلیگرمی: در موارد متوسط تا شدید بیماری؛ 23 میلیگرم یک بار در روز، در صورتی که بیمار به مدت 3 ماه روی دوز 10 میلی گرم روزانه، پاسخ مناسب داشته و عوارض تجربه ننموده باشد |
محلول یا قرص سریع رهش:ابتدا، 4 میلی گرم دوبار در روز و سپس افزایش دوز تا 8 میلی گرم دوبار در روز پس از 4 هفته؛ حداکثر دوز مجاز روزانه :24 میلی گرم کپسول پیوسته رهش:ابتدا 8 میلی گرم روزانه و سپس افزایش دوز تا 16 میلی گرم روزانه پس از 4 هفته حداکثر دوز مجاز روزانه :24 میلی گرم |
کپسول:ابتدا 5.1 میلی گرم دوبار در روز و سپس افزایش دوز به میزان 3 میلی گرم در روز (5.1 میلی گرم در هر دوز ) هر دو هفته تا حداکثر دوز 6 میلی گرم دوبار در روز پچ پوستی:ابتدا پچ 6.4 میلی گرم / 24 ساعت روزانه؛ بعد از حداقل 4 هفته افزایش دوز تا پچ 5.9 میلی گرم / 24 ساعت روزانه |
|
نحوهی تجویز |
دارو هنگام خواب مصرف شود. انتظار می رود عوارض گوارشی در عرض یک تا سه هفته برطرف شوند قرص23-میلی گرمی:کامل بلعیده شود؛ جویده، شکسته و خرد نشود. قرص های بازشونده در دهان:قبل از مصرف قرص، نبایستی از داخل محفظه خارج شده و نبایستی با دست مرطوب/ خیس لمس گردند. قرص باید بر روی زبان قرار داده شده و اجازه داده شود تا حل گردد.پس از حل شدن، بیمار باید یک لیوان آب مصرف نماید. بایستی از بلعیدن کامل قرص ها پرهیز گردد. |
محلول:قبل از نوشیدن باید با 120 میلی لیتر آب و یا نوشیدنی غیر الکلی مخلوط شود. کپسول پیوسته رهش: این شکل دارویی باید کامل بلعیده شده و جویده، شکسته و خرد نشود. |
پچ پوستی: هر روز در زمان مشخص پچ تحت استفاده برداشته و پچ جدید بر روی پوست تمیز، خشک و سالم در ناحیه پشت، سینه و یا بازو قرار داده شود. پچ جدید بایستی در محل جدید چسبانده شده و از چسباندن پچ در یک محل در فاصله کمتر از 14 روز خودداری شود. پچ بایستی قبل از انجام MRI از پوست جدا شود. در هنگام استفاده از پچ، بایستی از برنزه کردن پوست، آفتاب گرفتن، استفاده از پتوهای الکتریکی، استفاده از سونا و حمام آب گرم پرهیز شود. |
|
توصیه به بیمار |
برایکاهشعوارضگوارشیهمراهغذامصرفگردد. درصورتفراموشکردنمصرفداروبهمدتچندروزمتوالی،باپزشکخودمشورتنمایید. ممکناستنیازبهشروعمجددداروباکمتریندوزوسپسافزایشتدریجیآنتادوزکنونیباشد. |
||
جدول 2- مهارکنندههای آنزیم استیل کولین استراز؛مرور
|
دارو |
ممانتین |
|
عارضهی جانبی |
سرگیجه- گیجی- سردرد- اسهال- یبوست- افزایش فشار خون |
|
دوز |
شکل دارویی سریع رهش: ابتدا 5 میلی گرم روزانه و سپس افزایش دوز به میزان 5 میلی گرم در هر هفته، به مدت سه هفته، با هدف دست یابی به دوز 10 میلی گرم دوبار در روز در هفته چهارم. دوز های بالاتر از 5 میلی گرم در روز بایستی در دو دوز منقسم تجویز گردند. کپسول پیوسته رهش: ابتدا 7 میلی گرم روزانه و سپس افزایش دوز تا 14 میلی گرم یک بار در روز پس از یک هفته |
|
نحوهی تجویز |
محلول خوراکی: محلول خوراکی بایستی با استفاده از وسیله اندازه گیری فراهم شده، کشیده شده و به کناره دهان بیمار وارد گردد. این محلول نبایستی با مایعات دیگر مخلوط گردد. قرص سریع رهش: این شکل دارویی بایستی به صورت کامل و همراه با آب مورد استفاده قرار گیرد. کپسول پیوسته رهش:کامل بلعیده شود و یا بازگردد و محتویات آن با پورهی سیب مخلوط شده و بلافاصله توسط بیمار مورد استفاده قرار گیرد. |
|
توصیه به بیمار |
در صورت فراموش کردن مصرف دارو به مدت چند روز متوالی، با پزشک خود مشورت نمایید. شاید نیاز به شروع مجدد دارو با کمترین دوز و سپس افزایش تدریجی آن تا دوز کنونی باشد. |
جدول 3- مهارکنندهی گیرندهی ان- متیل دی- آسپارتات
رویکرد مدیریت عوارض جانبی داروهای مهارکنندهی استیل کولین استراز
از آنجا که اثرات این دستهی دارویی نسبی هستند، پزشک قبل از تجویز باید از سود بردن بیمار از این درمان دارویی اطمینان حاصل نماید تا از تجویز داروهای متوالی برای برطرف کردن عارضهی داروهای تجویز شده در ابتدا جلوگیری گردد.
- تهوع و اسهال[24] : شایعترین عارضهی داروهای این دسته عوارض گوارشی شامل تهوع، استفراغ و اسهال می باشند. این عارضه وابسته به دوز بوده و در غالب موارد با گذشت زمان یا کاهش دوز بهبود مییابد. در مورد داروی ریواستیگمین خوراکی، تجویز دارو به صورت دوزهای پایین تر و با تواتر بالاتر یا تغییر آن به فرم پچ پوستی ممکن است کمک کننده باشد.هر دو داروی ریواستیگمین و گالانتامین بایستی به همراه غذا مصرف گردند. از آنجا که احتمال بروز عارضهی گوارشی با دونپزیل نسبت به دو داروی دیگر این دسته کمتر می باشد، در صورت عدم تحمل ریواستیگمین یا گالانتامین، تغییر آنها به دونپزیل منطقی به نظر میرسد.
- بیاشتهایی و کاهش وزن: این عارضه توسط داروهای این دسته نسبت به دارونما بیشتر اتفاق میافتد اما به علت آنکه بیماری دمانس نیز با کاهش وزن در ارتباط است، تشخیص اهمیت بالینی این عارضه در بیمار دشوار خواهد بود. بیماران تحت درمان با این دستهی دارویی که دچار عارضهی کاهش وزن میشوند، قبل از قطع دارو باید از لحاظ تغذیه مورد مشاوره قرار گیرند. بیماری آلزایمر غالبا با از دست رفتن حس بویایی همراه است و در نتیجه این اتفاق از حس چشایی بیمار کاسته می شود. افزایش طعم غذا با استفاده از ادویه، طعم شیرینی و ترشی و یا استفاده از سس سویا ممکن است موجب افزایش اشتهای بیمار گردد.در بیمارانی که علاوه بر بیماری آلزایمر به افسردگی نیز مبتلا هستند، داروی ضد افسردگی میرتازپین با توجه به احتمال عارضه افزایش اشتها با آن، ممکن است گزینهی مناسبی تلقی گردد.
- افت ضربان قلب و فشار خون[25]: کاهش تعداد ضربان قلب[26]، بلوک قلبی[27] و سنکوپ میتواند در نتیجه افزایش تون عصب واگ[28] اتفاق بیفتد. در بیمارانی که دچار افت ضربان قلب و فشار خون علامتدار، بدون وجود هیچ علت مشخص دیگر مانند مصرف همزمان داروهای کاهندهی فشار خون، میگردند، درمانهای کولینرژیک باید قطع گردند. داروهای مهارکنندهی آنزیم استیل کولین استراز در افراد با ضربان قلب پایه پایین و یا بیماری سیستم هدایتی قلب شناخته شده منع مصرف دارند.
- اختلالات خواب[29]: بیخوابی، خواب دیدنهای واضح و سایر اختلالات خواب با داروی دونپزیل نسبت به دو داروی دیگر این دسته شایعتر هستند. در صورت بروز کابوسهای شبانه، تغییر دادن زمان مصرف دارو به صبح هنگام و یا استفاده از داروی جایگزین توصیه میگردد.
رژیم های چند دارویی
به علت تغییر نیازهای دارویی فرد سالمند مبتلا به آلزایمر به دلیل زوال قدرت شناخت و علائم روانی و رفتاری مرتبط با آن، تجویز دارو برای این افراد با چالش رو به رو است. علاوه بر این، تعداد بیشتری از داروها به منظور مدیریت بیماریهای همراه در جمعیت سالمند مورد نیاز هستند. اگرچه گاهی تجویز این تعداد دارو برای برخی از افراد ضروری است، اما این امر، به ویژه در افراد مسن، منجر به ایجاد نگرانی در مورد افراد جامعه میگردد زیرا بروز خطای دارویی، عدم همکاری بیمار و تداخلات دارویی را افزایش میدهد. از آنجا که افراد مبتلا به آلزایمر به مرور قدرت تصمیمگیری خود را از دست داده و در اثر این مورد توانایی بیان عارضهی دارویی در آنها کاهش مییابد، مراقبتهای محتاطانهتری در این گروه خاص از جامعه ضروری است. مطالعات همهگیر شناسی حاکی از آن است که دریافت تعداد زیادی دارو با مصرف غیر ضروری و نامناسب آن در ارتباط است. کرایتریای Beers[30] دارای فهرست داروهایی است که به علت عارضه بالا نباید در جمعیت سالمند تجویز شوند و یا تجویز آنها موجب افزایش بستری غیر ضروری بیماران سالمند میگردد.
در غالب موارد در مطالعات چند دارویی، بر روی جمعیت سالمند بدون دمانس و یا افراد مبتلا به دمانس مقیم در مراکز نگهداری از سالمندان تمرکز شده است و اطلاعات ناچیزی در مورد مصرف داروهای نسخهای در افراد جامعه در دسترس است. از آنجا که درصد زیادی از این افراد در آستانهی بستری شدن در مراکز نگهداری هستند، بررسی رژیم دارویی آنها برای جلوگیری از بروز مشکلات آتی (زمین خوردن و بروز مشکلات رفتاری) ضروری است (3).
مطالعات در حال انجام و ترکیبات جدید احتمالی
افزایش دانستههای بشر از پاتوفیزیولوژی بیماری آلزایمر منجر به گسترش تحقیقات بر روی ترکیبات جدید با هدف یافتن درمان برای بیماری شده است. در فرآیند گسترش داروهای آلزایمر در سال 2018 ، تعداد 112 ترکیب در فازهای اول، دوم و سوم کارآزمایی در حال بررسی بوده اند، که 63% از آنها از دسته ترکیبات تعدیلکننده[31] با هدف بهبود بخشیدن بیماری قرار داشتند. یک چهارم داروهای در دست بررسی برای بهبود شناخت مورد آزمایش قرار گرفتند که میتوانند منجر به بهبود حافظه، زبان، تفکر و قضاوت گردند. به طور تقریبی 10% از داروها ممکن است اختلالات رفتاری مانند بی قراری، فقدان احساس و اختلالات خواب را کاهش دهند.
اکثر داروهای تعدیلکنندهی بیماری، پروتئینهای آمیلوئید بتا و یا تائو را مورد هدف قرار میدهند. مهار آنزیم سکرتاز که در تولید پروتئین آمیلوئید بتا از پروتئین پیشساز آمیلوئید دخیل است، مکانیسم اثر اولیهی بسیاری از ترکیبات جدید می باشد. مهارکنندههای آنزیم بتا- سکرتاز [32] این آنزیم را که در مرحلهی اول شکست پروتئین پیشساز آمیلوئید نقش دارد، هدف قرار میدهند در حالی که مهارکنندههای آنزیم گاما- سکرتاز در مرحلهی دوم شکست پروتئین پیشساز فعالیت مینمایند. بسیاری از مهارکنندههای آنزیم بتا- سکرتاز قابلیت کاهش تولید پلاکهای آمیلوئید بتا را از خود نشان دادهاند اما نتوانستهاند در از بین بردن پلاکهای ایجاد شده و بهبود شناخت موثر واقع شوند. به علاوه این ترکیبات برای اثرگذاری باید در مراحل اولیهی سیر بیماری تجویز گردند که معمولا بیماری در این زمان تشخیص داده نشده است. از آنجا که آنزیم بتا- سکرتاز علاوه بر پروتئین پیشساز آمیلوئید، پروتئینهای حیاتی بسیاری را در مغز تجزیه مینماید، محققان در صدد یافتن روشهایی مناسب برای مهار تولید آمیلوئیدهای بتا با کمترین عارضهی جانبی هستند.
تمرکز روزافزون داروهای تعدیلکنندهی بیماری، بر روی هدف قرار دادن پروتئینهای تائو است. اگرچه مطالعات اولیه در این زمینه نتایج امیدوارکنندهای در پی نداشته اند، اما این تحقیقات، سوالات جدیدی را مطرح نمود که منجر به بررسی راهکارهای جدید از جمله ایمنی درمانی در فاز اول و دوم یک کارآزمایی بالینی گردید. بسیاری از داروها برای تسکین بخشیدن علائم رفتاری بیماری آلزایمر مورد مطالعه قرار گرفتند که پیش از آن برای درمان بیماریهای دیگر تاییدیه گرفته بودند. گاهی اوقات این ترکیبات میتوانند از فاز پیشبالین وارد فاز دوم کارآزمایی بالینی شده و سیر تحقیقات را سریعتر طی نمایند. تعدادی از داروهای واجد اثرات تعدیل کننده احتمالی شامل اس سیتالوپرام و میرتازپین ، کاربامازپین و لوتیراستام،لیتیم و متیل فنیدات می باشند.
بر خلاف تحقیقات گسترده، علت زمینهای قطعی، این بیماری پیچیده، همچنان مشخص نشده است. احتمالا درمانهای ترکیبی مورد نیاز است اما مطالعات بر روی درمانهای تک دارویی تمرکز نمودهاند. معمولا درمانهای جدیدی که در مدلهای حیوانی مورد بررسی قرار گرفتهاند، فاقد ارزش اخباری در انسان بوده و بسیاری از داروها که بر روی مدلهای انسانی آزمایش شدهاند، فاقد اثربخشی و یا دارای مجموعه عوارض غیر قابل قبول بودهاند. از طرفی، جذب داوطلب و نگهداری آنها برای فرآیندهای طولانی کارآزماییهای بالینی کاری دشوار است و وارد کردن یک داروی منتخب به بازار هزینههای گزافی را در پی دارد.
نقش داروساز
به علت پیچیدگی بیماری آلزایمر، درمانهای حال حاضر تنها در کنترل علامت های بالینی کمک کننده بوده و پیشرفت بیماری را با تاخیر مواجه می نمایند. مطالعات بالینی جدید با سوق دادن تمرکز به سمت اصلاح بیماری، در حال تغییر دادن درمان بیماری آلزایمر هستند اما اطلاعات بیشتری برای ورود این فرآوردهها به بازار دارویی مورد نیاز است. داروساز جایگاهی ایدهآل نه تنها برای اطمینان بخشیدن به مصرف ایمن و اثربخش دارو توسط بیمار، بلکه برای معرفی درمانهای بهروز دنیا دارا است. همچنین به عنوان یکی از در دسترسترین اعضای کادردرمان، داروساز میتواندبرای روشن ساختن انتظارات واقعبینانه از درمان با اعضای خانوادهی بیمار در ارتباط باشد. از آن رو که بیش از صد ترکیب در دست بررسی هستند، نقش داروساز در مدیریت بیماری آلزایمر در حال گسترش است.
تهیه وتنظیم
دکتر زهرا رضایی/دکتر محمد سلدوزیان
(دستیاران داروسازی بالینی)
منابع
1. Hardy JA, Higgins GA. Alzheimer's disease: the amyloid cascade hypothesis. Science. 1992;256(5054):184-6.
2. Thakur A, Kamboj P, Goswami K. Pathophysiology and management of alzheimer’s disease: an overview. J Anal Pharm Res. 2018;9(2):226-35.
3. Lau DT, Mercaldo ND, Harris AT, Trittschuh E, Shega J, Weintraub S. Polypharmacy and potentially inappropriate medication use among community-dwelling elders with dementia. Alzheimer Dis Assoc Disord. 2010;24(1):56.
4. Daniel Press, MD. Michael Alexander, MD. Cholinesterase inhibitors in the treatment of Alzheimer disease. This topic last updated: Oct 30, 2019. Accessed on August 14, 2020 via https://www.uptodate.com/contents/cholinesterase-inhibitors-in-the-treatment-of-alzheimer-disease
5. C. Dirk Kneene, MD, PhD. Thomas J Montine, MD, PhD. Lewis H Kuller, MD, DrPH. Epidemiology, pathology, and pathogenesis of Alzheimer disease. This topic last updated: Jan 19, 2018. Accessed on August 14, 2020 via https://www.uptodate.com/contents/epidemiology-pathology-and-pathogenesis-of-alzheimer-disease
[1]Amyloid precursor protein (APP)
[2]Tau Protein
[3]Frontotemporal
[4]e4 allele of apolipoprotein E (ApoE)
[5]Cross-sectionalstudies
[6]Longitudinal cohort studies
[7]Observationalstudies
[8]Low-Density Lipoprotein Cholesterol (LDL-C)
[9]Astrocytes
[10]High-Density Lipoprotein (HDL)
[11]Randomized Trials
[12]Cerebral Blood Flow (CBF)
[13]Vascular Dementia
[14]Neuropathologic Features
[15]Clinicopathologic Studies
[16] Pre symptomatic
[17]Case-Control Study
[18]Confounders
[19]Proton Pump Inhibitors
[20]Dichlorodiphenyldichloroethylene (DDE)
[21]Neurotransmitter
[22]Memantine
[23]N-methyl-d-aspartate receptor antagonist
[24]Nausea and diarrhea
[25]Bradycardia and hypotension
[26] Bradycardia
[27]Heart block
[28]Vagus nerve
[29]Sleep disturbances
[30]Beers criteria
[31]Disease-Modifying Therapies (DMTs)
[32]Beta-site APP-cleaving enzyme (BACE) inhibitors

ارسال نظر